Aunque no lo parezca, el tipo de la imagen es un científico. Uno de los mejores. También es músico, claro. Es Harry Noller, en la actualidad, Professor emeritus de biología molecular, celular y del desarrollo en la Universidad de California, Santa Cruz (UCSC), lugar al que llegó en 1968 para su última entrevista de trabajo. Al salir del coche se encontró rodeado de un precioso bosque de secuoyas centenarias y pensó que aquel era el lugar donde quería trabajar el resto de su vida. Con el corazón ya rendido, su inconsciente debió tropezarse con las palabras que años antes había recibido del gran Sydney Brenner y decidió «aceptar de inmediato cualquier oferta que me hicieran» (1). Con solo 3 años de existencia, la UCSC era todo un experimento educativo, creada con el convencimiento de que podía cambiar el mundo si profesores y alumnos perdían el miedo a pensar diferente:
We were founded knowing that challenging the status quo wasn’t part of the problem: It was the solution.
George Blumenthal (Chancellor, UCSC)
El status quo no es más que un estado transitorio. Esto lo acaba enseñando la experiencia pero, en ocasiones luminosas, cuando uno es joven, lo susurra el instinto. Afortunadamente, por aquel entonces Harry Noller «no tenía miedo, era idealista e inocente» (1). Lo que había aprendido de Brenner, en Cambridge, era que la única persona que podía decidir su futuro era él mismo. Y eso incluía encontrar el sitio adecuado para desarrollar su carrera investigadora. Enseguida se dio cuenta de que «por allí no había muchos de esos expertos que suelen desanimarte cuando quieres tomar direcciones inusuales» (1) y supo que era el lugar y el momento de iniciar su particular viaje a lo desconocido. En 1968 estudiar el ribosoma era, desde luego, adentrarse en terreno desconocido pero Harry tuvo la valentía para intentarlo y la ilusión, el tesón y el talento necesarios para convertir el viaje en una apasionante aventura.
En 2009, la Real Academia Sueca de las Ciencias concedió el premio Nobel de Química a Venkatraman Ramakrishnan (USA), Thomas A. Steitz (USA) y Ada E. Yonath (Israel), por sus «estudios sobre la estructura y función del ribosoma«. La ausencia de Harry Noller en la lista de premiados es una injusticia histórica que solo puede explicarse por la norma que limita a tres el número máximo de laureados y que únicamente es mitigada por el hecho incontestable de que Ramakrishnan, Steitz y Yonath reunían méritos más que suficientes para recibir el galardón. La dinamita que hizo rico a D. Alfred Nobel se fabricaba con nitroglicerina y silicio de diatomeas. Hoy, la nitroglicerina te salva de un infarto y el silicio se funde en Silicon Valley -para que luego digan que no hemos avanzado- así que los nuevos mecenas de la ciencia son CEOs que llegan a lomos de gigantes o de unicornios. No quieren esperar a que un notario lea su testamento para pasar a la posteridad, mayormente porque posteridad suena a post y eso mejor lo hacemos ya, que para algo ellos nos dan las herramientas. O sea, que en 2012, los fundadores de Google, Facebook et al. crearon los premios Breakthrough con el objetivo de “inspirar una cultura del conocimiento” y eso nos parece muy bien, claro que sí. Precisamente, uno de los premiados de este año, en la categoría de Ciencias de la Vida, ha sido Harry Noller por «descubrir la importancia del ARN en formar los centros activos del ribosoma (…) conectando, por tanto, la biología moderna con los orígenes de la vida y explicando también cómo los antibióticos naturales bloquean la síntesis de proteínas». Un premio más que merecido.
UCSC biologist Harry Noller has won a $3 million @brkthroughprize in Life Sciences! A monumental achievement indeed. https://t.co/Bh7WgDVcfg
— UC Santa Cruz (@ucsc) December 5, 2016
@ucsc's Harry Noller receiving the @BreakthroughPrize. Congratulations Harry! #thinkucsc #breakthroughprize @UCSC_BSOE pic.twitter.com/ORwx816yEt
— Alexander Wolf (@BSOE_Dean) December 5, 2016
A finales de los 60 ya se sabía que el ribosoma era una ribonucleoproteína pero, sin datos que lo demostraran, los científicos asumían que la responsable de la actividad enzimática, la pieza clave de la maquinaria, eran las proteínas. La visión de Harry Noller no difería mucho de la estándar y, como recién estrenado Assistant Professor en UCSC, decidió concentrar sus esfuerzos en investigar qué proteína -de entre más de 50- era la responsable de la principal función del ribosoma: catalizar el enlace peptídico. Era, por otra parte, continuación lógica del trabajo postdoctoral que había realizado con Alfred Tissières en Ginebra. Su estrategia consistía en tratar las subunidades ribosomales con compuestos químicos capaces de modificar proteínas, esperando dañar la actividad enzimática e identificar a continuación la proteína que había sido modificada. Como en toda historia que merezca la pena, estos primeros años fueron descorazonadores, con explosiones en el laboratorio incluídas (1) y sin un solo resultado positivo que permitiera vislumbrar el camino a seguir. Y también como en las mejores historias, el momento eureka llegó empujado por ideas poco ortodoxas, ese think outside the box o think different que tan necesario es en la investigación científica. Un reactivo, el rosa de bengala consiguió finalmente inactivar la función del ribosoma pero, a diferencia de los otros que habían probado, este compuesto no solo había modificado las proteínas sino también el ARN ribosomal (rRNA) 16S. En 1972, la reacción ortodoxa a tal resultado habría sido obviar la modificación en el ARN y seguir dando palos de ciego sobre las proteínas modificadas por el rosa bengala. Pero Harry Noller es el tipo que, siendo un muchacho, se presentó un día en la Universidad de Berkeley, se acercó a una recepcionista y le dijo que «quería saber qué era eso de la bioquímica» (1). Todo un freewheeling. Lo maravilloso de la historia es que la mujer telefoneó a un eminente profesor del departamento correspondiente quien, con la mayor amabilidad y paciencia, recibió a aquel muchacho inquieto y durante una hora le explicó qué era eso de la bioquímica. Toda una lección para los que nos dedicamos a esto.
 Harry Noller en plena acción (1970), en su laboratorio de UCSC. Copyright 2016 Regents of the University of California
Harry Noller en plena acción (1970), en su laboratorio de UCSC. Copyright 2016 Regents of the University of California
Así que, en 1972, el think different de Harry Noller se resumía en la pregunta ¿no será el ARN, en lugar de las proteínas, el responsable de la actividad enzimática del ribosoma? Otro reactivo, el ketoxal, que modifica específicamente los nucleótidos de guanina daría a Noller la respuesta a su pregunta y a su estudiante los resultados necesarios para finalizar, por fin, su proyecto de fin de grado. El trabajo, ya clásico, se publicó en la revista PNAS (2) y demostraba que la modificación de tan solo una decena de guaninas en el rRNA 16S era suficiente para inactivar el ribosoma. Además, la mayoría de esas guaninas quedaban protegidas si se incluía en el ensayo la otra clase de ARN que uno puede encontrar en un ribosoma: el ARN transferente (tRNA), sugiriendo que las regiones del rRNA 16S coincidentes o cercanas al sitio de unión del tRNA constituían el centro activo del ribosoma.
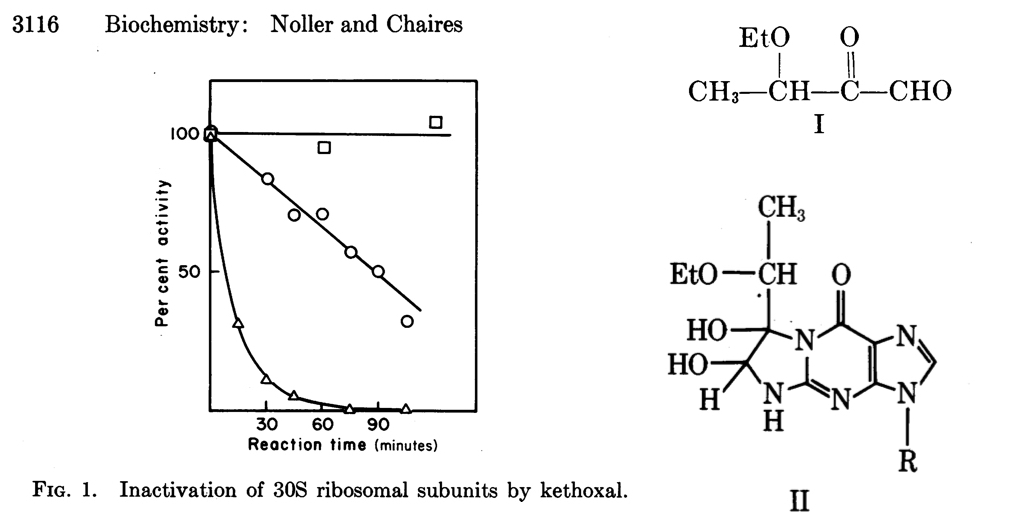 Izda: actividad peptidil transferasa de ribosomas con subunidades 30S sin tratar (cuadrados) o tratadas con ketoxal (triángulos). Con este experimento, Noller demuestra que la modificación química del rRNA 16S inactiva la función ribosomal y que la presencia de tRNA en la reacción (círculos) protege de la modificación. Dcha: estructura química del ketoxal (I) y guanina modificada por ketoxal (II). Todas las figuras proceden de la Ref. 2
Izda: actividad peptidil transferasa de ribosomas con subunidades 30S sin tratar (cuadrados) o tratadas con ketoxal (triángulos). Con este experimento, Noller demuestra que la modificación química del rRNA 16S inactiva la función ribosomal y que la presencia de tRNA en la reacción (círculos) protege de la modificación. Dcha: estructura química del ketoxal (I) y guanina modificada por ketoxal (II). Todas las figuras proceden de la Ref. 2
Harry tenía por delante una complicada tarea: convencer a la comunidad científica de que estaba equivocada. Y no en relación a un asunto precisamente menor sino -ahí es nada- al mecanismo universal mediante el cual las células síntetizan sus proteínas.
That was the beginning of showing that the function of the ribosome is not based on protein, it’s based on RNA. The only problem was, it was so unexpected that nobody believed it.
Harry Noller
El camino a seguir pasaba irremediablemente por la identificación de las guaninas concretas que quedaban protegidas por el tRNA. Era la década prodigiosa y la Biología Molecular progresaba adecuadamente pero aún se acababa de levantar por el horizonte -que para eso estaban en la era de Acuario- y los protocolos para secuenciar ARN parecían más bien sacados de una comuna medio hippie medio santera: moléculas de ARN radiactivas se mezclaban con extractos de visceras de ternera, gusanos de seda o veneno de serpiente y se depositaban en unos papelillos impregnados en ácido antes de iniciar un viaje en varias dimensiones. Los «extractos» eran las ribonucleasas, con distintas actividades endo- y exo-, que permitían a Noller degradar el rRNA 16S en sus nucleótidos individuales mientras que la electroforesis bidimensional, en presencia de ácido fórmico, le permitía separarlos en DEAE-celulosa (la secuenciación en gel aún no existía) para su identificación.
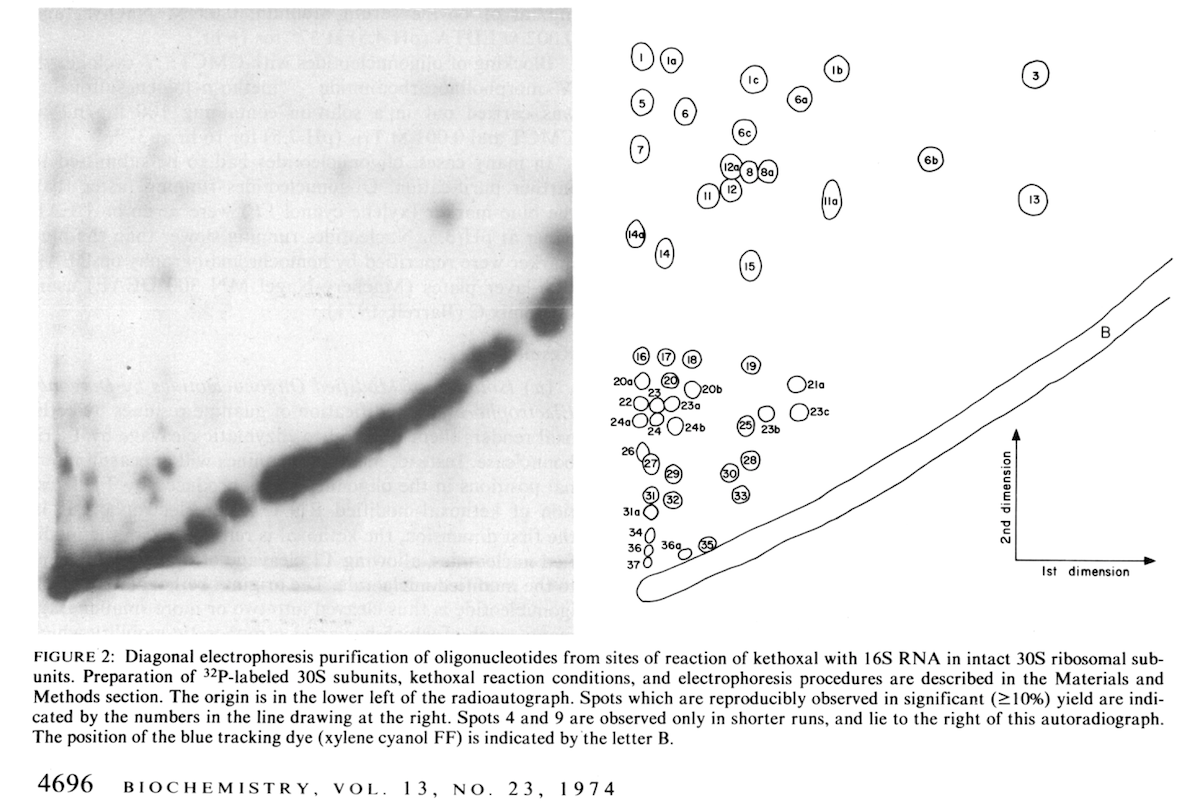 Separación, mediante electroforesis bidimensional en papel de DEAE-celulosa, de oligonucleótidos generados por digestión del rRNA 16S, previamente marcado radiactivamente con 32P y tratado con ketoxal para identificar los residuos protegidos por el tRNA. Las manchas (spots) que aparecen alejados de la diagonal contienen oligonucleótidos con guaninas no modificadas por el ketoxal (protegidas por el tRNA). Imagen original tomada de la Ref. 3
Separación, mediante electroforesis bidimensional en papel de DEAE-celulosa, de oligonucleótidos generados por digestión del rRNA 16S, previamente marcado radiactivamente con 32P y tratado con ketoxal para identificar los residuos protegidos por el tRNA. Las manchas (spots) que aparecen alejados de la diagonal contienen oligonucleótidos con guaninas no modificadas por el ketoxal (protegidas por el tRNA). Imagen original tomada de la Ref. 3
Fueron años de duro trabajo en los que Harry obtuvo numerosas secuencias parciales que, para su desesperación, no siempre coincidían con las secuencias rRNA 16S que otros habían publicado con antelación. Afortunadamente, nuestro amigo siempre tuvo el jazz, su otra gran pasión, para sobrellevar -y, al fin, recomponer- los inevitables experimentos fallidos. En ocasiones, regresaba al laboratorio tras actuar en algún auditorio local y, de la misma manera que improvisaba melodías al compás de su banda, era capaz de improvisar nuevos experimentos al compás de los inesperados acordes que los resultados le dictaban.
Science has a creative component to it. Ideas that propel experiments come from a creative source. Scientists are often musicians, artists, people with diverse interests.
Harry Noller
Una conversación con otro científico outsider, y también amante del jazz, Carl Woese -el hombre que descubrió las arqueobacterias y reescribió el árbol filogenético de la vida- le convenció de que las secuencias publicadas eran incorrectas (1). Si quería identificar con precisión los sitios activos en el ribosoma, no tendría más remedio que obtener, él mismo, la secuencia completa del rRNA 16S. Una tarea que, con la tecnología disponible en aquella era de Acuario, se antojaba-ya lo hemos visto- titánica. Pero si los mecenas de hoy llegan a lomos de sus gigantes tecnológicos, los científicos de siempre avanzamos a hombros de gigantes de carne y hueso y, en 1975, Harry Noller lo haría encaramado a uno de los más grandes, el dos veces premio Nobel Frederick Sanger.
Alguien del equipo de Sanger había presentado, en una Gordon Research Conference, un novedoso sistema de secuenciación de ADN en geles y la noticia había llegado a Harry, quien andaba preparándose para un sabático en Europa. Tras telefonear a Fred, acordaron que pasaría un tiempo en su laboratorio, en Cambridge, para aprender la nueva técnica de secuenciación. No estaban seguros de si la técnica funcionaría con ARN pero tampoco hizo falta intentarlo: el sabático incluía una estancia en Ginebra con su antiguo mentor, Alfred Tissières, y allí se enteró de que alguien tenía un fago λ con el operón completo rrnB, incluyendo los genes rRNA 16S y 23S de E. coli. Por sencillo que hoy nos pueda parecer, digerir un fragmento de ADN con enzimas de restriccción y ligarlo en un plásmido era alta tecnología en 1975, así que, básicamente, Harry dedicó el tiempo en Cambridge a aprender la técnica de secuenciación y a clonar los genes rRNA en un primitivo plásmido ColE1. Tras el sabático, tuvo que convencer a su director de departamento de que necesitaba más espacio donde alojar los 16 equipos de secuenciación en gel que, con la inestimable ayuda económica de Woese, había adquirido y dedicó todos sus esfuerzos a obtener las secuencias completas de los rRNA 16S y 23S. Así, en junio de 1978, presentaron en Salamanca la secuencia del rRNA 16S de E. coli. El congreso había sido organizado por el gran microbiólogo español David Vázquez, reconocido experto en el mecanismo de acción de los antibióticos y maestro de varios prestigiosos investigadores de nuestro país (Mariano Barbacid, entre ellos). Vázquez era una autoridad mundial y muchos de los mejores congresos internacionales sobre síntesis de proteínas y antibióticos fueron organizados por él. Con frecuencia, los congresos proporcionan el entorno adecuado para que, entre tanto científico inquieto, surgan las ideas que marcarán tendencia en los años venideros. La época (año 78) no era propicia pero, en otro momento, se hubiera reconocido más la contribución pionera de Vázquez y Noller a la alta peluquería pues, en una noche inspirada, entre ambos crearon el corte de pelo asimétrico, tan en boga estos días:
Late at night after much partying, Vázquez was in fine form, on the loose in the bar with a dangerous-looking saber, demonstrating some kind of African sword dance. A well meaning attendee talked him out of the knife by trading in it for a pair of scissors. Vázquez then began cutting chunks of hair off the heads of scientists in the bar, leaving a stream of bald patches in his wake, urged on by a cheering crowd. When he spotted me (picture), a huge cheer went up as he cut off a two-foot-long fistful of hair, leaving me lopsided but otherwise mostly intact.
Harry Noller (from Ref. 1)
En los años siguientes, el grupo de Noller determinó la secuencia completa del operón rrnB, incluída la del rRNA 23S y las de rRNAs de otras especies. Tanta información, excesiva para un ordenador estándar de finales de los 70, les obligó a gastar 30.000 dólares en un nuevo equipo, con unos «impresionantes» 86 MB de disco duro, y a desarrollar un rudimentario programa de alineamiento de secuencias (no existía Clustal, ni nada parecido) para procesar las secuencias que iban obteniendo. En colaboración con Woese, determinó la estructura secundaria de los rRNAs 16S y 23S (4,5) y realizó estudios comparativos con secuencias de diferentes especies. Poco a poco se iba ganando notoriedad como experto en ARN y ribosomas pero, para muchos, seguía siendo el tipo con la «estrafalaria idea» (1) de que los rRNAs, no las proteínas, eran los responsables últimos de la función ribosomal. El descubrimiento, por Thomas Cech en 1982, de las propiedades catalíticas del ARN (ribozimas) demostró que las proteínas no tenían los derechos exclusivos de la biocatálisis y, en gran medida, contribuyó a que las investigaciones de Noller se miraran con mejores ojos. Aún así, una cosa era el autosplicing del rRNA para su procesamiento y otra que el rRNA maduro, en el ribosoma, tuviera actividad catalítica. Tendría que pasar toda una década hasta que, a principios de los 90, Harry Noller y sus colaboradores, aportaran las pruebas definitivas.
 Secuencia y estructura secundaria del rRNA 16S de E. coli. Tomado de la Ref. 4
Secuencia y estructura secundaria del rRNA 16S de E. coli. Tomado de la Ref. 4
![]()
En 1990, la profesora Francisca (Kika) Sánchez-Jiménez, del Dpto. de Biología Molecular y Bioquímica de la UMA, acababa de volver de una estancia en el laboratorio de Frank Talamantes, localizado en el campus de la UCSC, en el mismo edificio y a escasos metros, del de Harry Noller. Allí había estudiado la expresión y función de varias hormonas reguladoras de la proliferación celular y, a su vuelta, andaba buscando a alguien que aislara ribosomas activos (polisomas) para estudiar la síntesis de dos proteínas -ornitina descarboxilasa (ODC) y proliferina- en células de tumor ascítico de Ehrlich. Yo acababa de solicitar un puesto de alumno interno en el departamento. Supongo que, en cierta manera como el joven Noller, quería saber qué era eso de la Biología Molecular, una asignatura que se impartía al final de la carrera y que resultaba fascinante. Kika me propuso desarrollar el proyecto y presentar los resultados en forma de tesina cuando me licenciara, al año siguiente. Eso implicaba poner a punto un protocolo de aislamiento de polisomas en gradientes de sacarosa pero nadie en el grupo tenía experiencia previa y, por la misma razón, ni siquiera disponíamos de algún material necesario -y caro- para preparlos. El proyecto sonaba interesante y todo estaba por hacer, ¿qué más podía pedir?.
Durante su estancia en UCSC, Kika coincidió en alguna ocasión con Harry Noller y lo recuerda así:
Cuando pedí que me dejaran utilizar el densitómetro de un laboratorio situado casi frente al mío en el edificio Thimann labs de UCSC a finales de 1988, no sabía que estaba en el mismo laboratorio que años después resolvería la estructura tridimensional y el carácter de ribozima del RNA ribosomal 23S. Estaba usando el densitómetro de Mr. Ribosome, un señor de aspecto típicamente californiano 100%, botas vaqueras y cabellera propias de un compañero de rodaje de Clint Eastwood, que tenía los ojos rasgados y tristes, y la mirada del que no puede parar de pensar. Yo no sabía distinguir entonces un experimento de huella de un gel de secuenciación fallido, y sin embargo ellos estaban a solo 3-4 años de caracterizar la naturaleza de ribozima de la subunidad ribosomal 50S (1992) y a casi una década de cristalizar un ribosoma completo (2001). En ese entorno UCSC, donde varios grupos (M. Ares, K. Moldave, H. Noller, entre otros) se empeñaban en desentrañar la estructura y dinámica de la síntesis de proteínas aprendí muchas cosas sobre cómo deben organizarse los centros de investigación (y los estados) para ser eficientes y productivos. Fue mi particular sueño americano. Se respiraba Biología Molecular en aquellos pasillos del Thimann Labs, y los investigadores jóvenes podían tener un futuro en el Sillicon Valley.
Cuando volví a coincidir con Harry Noller, hace tres años en el congreso FEBS de San Petersburgo, su pelo ya no era tan oscuro como a finales de los 80, sus ojos se habían cerrado un poco más, pero seguía fiel a su imagen. Su mirada es tan penetrante e inteligente como entonces. Cuando le saludé, me reconoció y me dio la impresión de que, al igual que yo, estaba recordando muy gratamente aquella época en la que yo caminaba hacia la Biología Molecular y él cabalgaba hacia el éxito científico. De hecho fue nominado en 2009 para el premio Nobel, y ha sido galardonado con otros varios premios muy prestigiosos. Ahora le han concedido el más que merecido premio Breakthrough. Él con su equipo “penetraron” en todos los “recovecos” (plegamientos e interacciones) de la “máquina biológica” que nos permite fabricar proteínas, y dedujo muchas de las características que hoy en día explicamos en cualquier curso de Biología Molecular. Así que no puedo más que sentirme muy afortunada de haber conocido un pionero (científico) y leyenda viva del oeste americano conocido con el seudónimo de Mr. Ribosome.
-Kika
Andaba yo entonces leyendo todo lo que caía en mis manos sobre ribosomas y síntesis de proteínas cuando me topé con un artículo publicado en Nature no hacía mucho (sin Internet, las revistas científicas nos llegaban por correo postal, meses después de su publicación). El artículo en cuestión estaba firmado por dos autores, Danesh Moazed y Harry Noller y el título, traducido, rezaba así «Estados intermedios en el movimiento del ARN transferente en el ribosoma» (6). Ese trabajo me impactó profundamente y recuerdo que, además de organizar un seminario para presentarlo al resto del grupo, se lo iba enseñando a todo el mundo a la más mínima ocasión. Fue el primer artículo científico que me influyó de manera especial y, visto en retrospectiva, seguramente fue el que asentó mi interés, desde entonces creciente, por conocer en detalle la dinámica de la maquinaria celular, la estructura de las biomoléculas, sus modificaciones y sus cambios conformacionales. Uno, con frecuencia, tenía la sensación de que los esquemas de los libros de texto eran demasiado simples, no tanto por la calidad de su grafismo, sino por lo rudimentario de su poder representativo. Por supuesto, esto no era culpa de los editores sino de la falta de datos experimentales. Pero mientras que un químico, o al menos eso suponía yo, podía recrear reacciones en su cabeza a la vista de simples fórmulas bidimensionales, era muy difícil, sin una estructura decente que echarse a las neuronas, recrear mentalmente la dinámica molecular de, por ejemplo, la síntesis de proteínas. En realidad, el artículo no mostraba estructura alguna (Noller aún tardaría otra década en resolver la estructura tridimensional del ribosoma) pero, frente a la visión clásica, en la que el tRNA poco menos que se teletransportaba dentro del ribosoma, desde el sitio A (aminoacil), al P (peptidil) y, de ahí, al E (exit), Moazed y Noller proponían un modelo dinámico del proceso que permitía entender no solo el tránsito del tRNA por los sitios A/P/E sino, también, el avance del ribosoma a lo largo de la molécula de ARN mensajero (mRNA). Como en la vida, no todo era blanco o negro sino que había una «escala cromática» de cambios moleculares y aquellos dos tipos mostraban un camino y una herramienta, la Biología Molecular, para descubrirlos.
Es sorprendente que la gente no crea que hay imaginación en la ciencia. Es un tipo de imaginación muy interesante, diferente de la del artista. La gran dificultad está en tratar de imaginar algo que uno no ha visto nunca, que sea consistente en todo detalle con lo que ya se ha visto, y que sea diferente de lo que se había pensado; además, debe ser una proposición precisa y no vaga. Eso es realmente difícil.
Richard P. Feynman
 Mi tesina (escrita en WordPerfect; el MSWord aún no había llegado), con la imagen de los estados intermedios del tRNA en el ribosoma, tomada del artículo de Moazed y Noller (6)
Mi tesina (escrita en WordPerfect; el MSWord aún no había llegado), con la imagen de los estados intermedios del tRNA en el ribosoma, tomada del artículo de Moazed y Noller (6)
![]()
Danesh Moazed formaba, junto a otros dos estudiantes, Seth Stern y Ted Powers, un trío de jóvenes colaboradores tan brillantes y trabajadores que, para Noller, parecían «enviados por la divina providencia» (1). Utilizando la técnica de huella, en la que se combinaban los experimentos de protección de la modificación por ketoxal con la retrotranscripción y secuenciación de los rRNAs, estos investigadores determinaron, a finales de los 80, los ya mencionados estados intermedios del tRNA, las sitios de unión de proteínas ribosomales (7), de factores auxiliares de la síntesis proteica (8) y, algo muy relevante, los sitios de unión de varios antibióticos (9). Una y otra vez, los trabajos de Noller demostraban un papel esencial del rRNA en la función ribosomal, sin embargo, ninguno probaba de manera inequívoca su función enzimática. Sería una conversación con el premio Nobel Phillip Sharp (descubridor del splicing) la que le abriría los ojos y le proporcionaría el estímulo necesario para diseñar los experimentos clave que le permitirían poner la guinda al pastel. Inactivó selectivamente las proteínas de la subunidad grande del ribosoma (50S) por desnaturalización con un detergente (SDS) o por digestión enzimática con proteinasa K y observó que, aún sin proteínas funcionales, el ribosoma retenía la actividad peptidil transferasa. Por el contrario, si eliminaba el rRNA 23S, mediante extracción con fenol o por digestión enzimática, con ribonucleasa T1, los ribosomas perdían la capacidad de sintetizar proteínas. Era una prueba definitiva. Mediante la demostración de que el rRNA participa directamente en la función catalítica del ribosoma, Harry había proporcionando, por fin, una evidencia consistente -la primera- de que el ribosoma es una ribozima. Los estudios estructurales más recientes, no han hecho sino confirmar, de manera inequívoca, esta función (11). En cuanto a las proteínas, su función principal parece ser la de facilitar el plegamiento correcto de los rRNA y facilitar el posicionamiento de los tRNAs. Algunos aminoácidos concretos colaboran en la función peptidil transferasa pero la actividad catalítica reside en el rRNA.
I was surprised at the RNA community´s reaction to this result, but it was a relief not to have to justify my passion for ribosomal RNA after that.
Harry Noller
 Harry Noller (izda) y Danesh Moazed (dcha). Copyright 2016 Regents of the University of California
Harry Noller (izda) y Danesh Moazed (dcha). Copyright 2016 Regents of the University of California
Una imagen vale más que mil palabras y, aunque Harry Noller había escrito, a mediados de los 90, muchísimas más que 1000 palabras sobre los ribosomas, no tenía -ni él ni nadie- una imagen molecular con suficiente resolución como para que, a su vista, no fueran necesarias mil palabras más. O sea, que no se conocía su estructura tridimensional. La verdad es que no era tarea sencilla: en términos moleculares, el ribosoma es un complejo de dimensiones gigantes (2,5 MDa), de composición mixta (RNA y proteínas) y, para más inri, asimétrico (formado por dos subunidades diferentes), lo que dificulta mucho la cristalización y la interpretación de los resultados. En realidad, el grupo de Ada Yonath ya había obtenido algunos cristales de subunidades ribosomales a mediados de los años 80, pero su calidad no era lo suficientemente buena como para obtener patrones de difracción que permitieran determinar la estructura atómica. Serían los grupos de la misma Yonath (Weizmann Institute), junto a los de Thomas Steitz (Yale University) y Venkatraman Ramakrishnan (MRC Cambridge) los que, durante la segunda mitad de los 90 obtendrían los cristales necesarios para determinar la estructura de las subunidades 50S y 30S a media-baja resolución (5-9 Å) y, ya en el siglo XXI, las de alta resolución (2,4-3,3 Å) que, como ya se ha comentado, les harían finalmente merecedores del premio Nobel (12-17).
 Desde los primeros y rudimentarios esquemas gráficos de ribosomas, fundamentalmente basados en imágenes de microscopía electrónica, hasta obtener las primeras imágenes con resolución atómica de las subunidades individuales (aquí se muestra la 50S) han sido necesarias cuatro décadas de investigación. Las imágenes de las estructuras 3D están tomadas de las Refs. 12-15
Desde los primeros y rudimentarios esquemas gráficos de ribosomas, fundamentalmente basados en imágenes de microscopía electrónica, hasta obtener las primeras imágenes con resolución atómica de las subunidades individuales (aquí se muestra la 50S) han sido necesarias cuatro décadas de investigación. Las imágenes de las estructuras 3D están tomadas de las Refs. 12-15
Por supuesto, Harry Noller también había intentado obtener los deseados cristales pero, a diferencia de los otros grupos, no le bastaba con cristalizar las subunidades ribosomales por separado. Él quería «ver» el ribosoma completo; las dos subunidades ensambladas sobre el mRNA y los tRNAs en sus posiciones funcionales. Necesitaba visualizar la maquinaria en su totalidad y, a ser posible, en funcionamiento. Para nuestro amigo Noller, no se trataba sólo de proporcionar mejores imágenes de una fachada que otros investigadores ya estaban fotografiando sino de entrar sin invitación en aquel laboratorio clandestino que escondía el ribosoma y pillar con las manos en la masa a la banda completa de sospechosos habituales. Aquello era una Misión Imposible y, de hecho, así llamo Harry al grupo de «espías» con talentos complementarios que logró reunir (1). Esta vez, los rusos estaban del lado de los americanos y en cuestión de meses el matrimonio de biólogos estructurales Marat Yusupov y Gulnara Yusupova generó cristales que difractaban a 12 Å. Un buen patrón de difracción era el punto necesario de partida pero, para obtener el mapa de densidad electrónica, alguien tenía que resolver el «problema de fases» y lo malo es que el ribosoma 70S, mRNA y tRNAs incluídos, contenía más de 200.000 átomos. Era el turno de Jamie Cate, un joven cristalógrafo recién llegado de Yale y forjado en el grupo de Jennifer Doudna (sí, la pionera de CRISPR-Cas9), donde había tenido que resolver la estructura de los intrones autocatalíticos. Decía el físico Edward Teller que «la ciencia es el proceso de transformar café en ideas» y, en 1998, el precio del café estaba en caída. Así que Noller, que para eso era el jefe del grupo, debió de hacer el cálculo, vió que la cosa podía ser rentable y montó el centro de operaciones en el sincrotrón ALS (Berkeley). Allí, el equipo de Misión Imposible iba transformando litros de café en ideas y kilos de donuts y costillas a la barbacoa en datos experimentales hasta que, un día, cruzando los datos que les proporcionaba el acelerador de partículas con los de cryo-EM que ya habían sido publicados (12), Jamie encontró una solución satistactoria al problema de fases y pudo generar un mapa de densidad electrónica:
The proof that we had independent phases came from a difference map from ribosomes that had a tRNA bound to the A site versus ones with a vacant A site. We crowded around the SGI monitor to look at the result. A chubby L-shaped density appeared in exactly the position that we had predicted for the A site from our bio- chemical work!. This was the aha moment.
Harry Noller (Ref. 1)
A partir de ahí, el grupo refinaría los datos hasta obtener estructuras publicables, primero a 7,8 Å (18) y, en 2001, a 5,5 Å (19). Ambos trabajos fueron portada de Science y, especialmente la segunda estructura, de mayor resolución, sigue siendo una referencia a día de hoy.
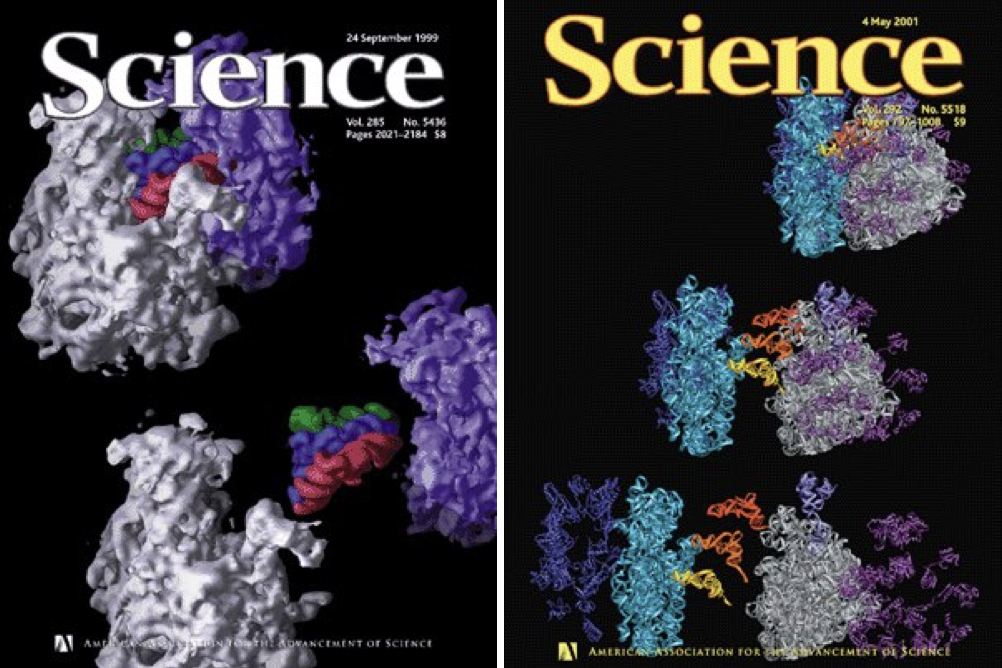 Portadas de los ejemplares de Science donde se publicaron las Refs. 18 y 19
Portadas de los ejemplares de Science donde se publicaron las Refs. 18 y 19
…We could see the whole thing: how the subunits fitted together with their dozen intersubunit bridges; how the tRNAs bound to the A, P, and E sites of the ribosome; and the path of the mRNA through the ribosome. As we anticipated, all of the functional sites were made almost exclusively of ribosomal RNA; the ribosomal proteins were scattered mainly around the periphery of the ribosome
Harry Noller (Ref. 1)
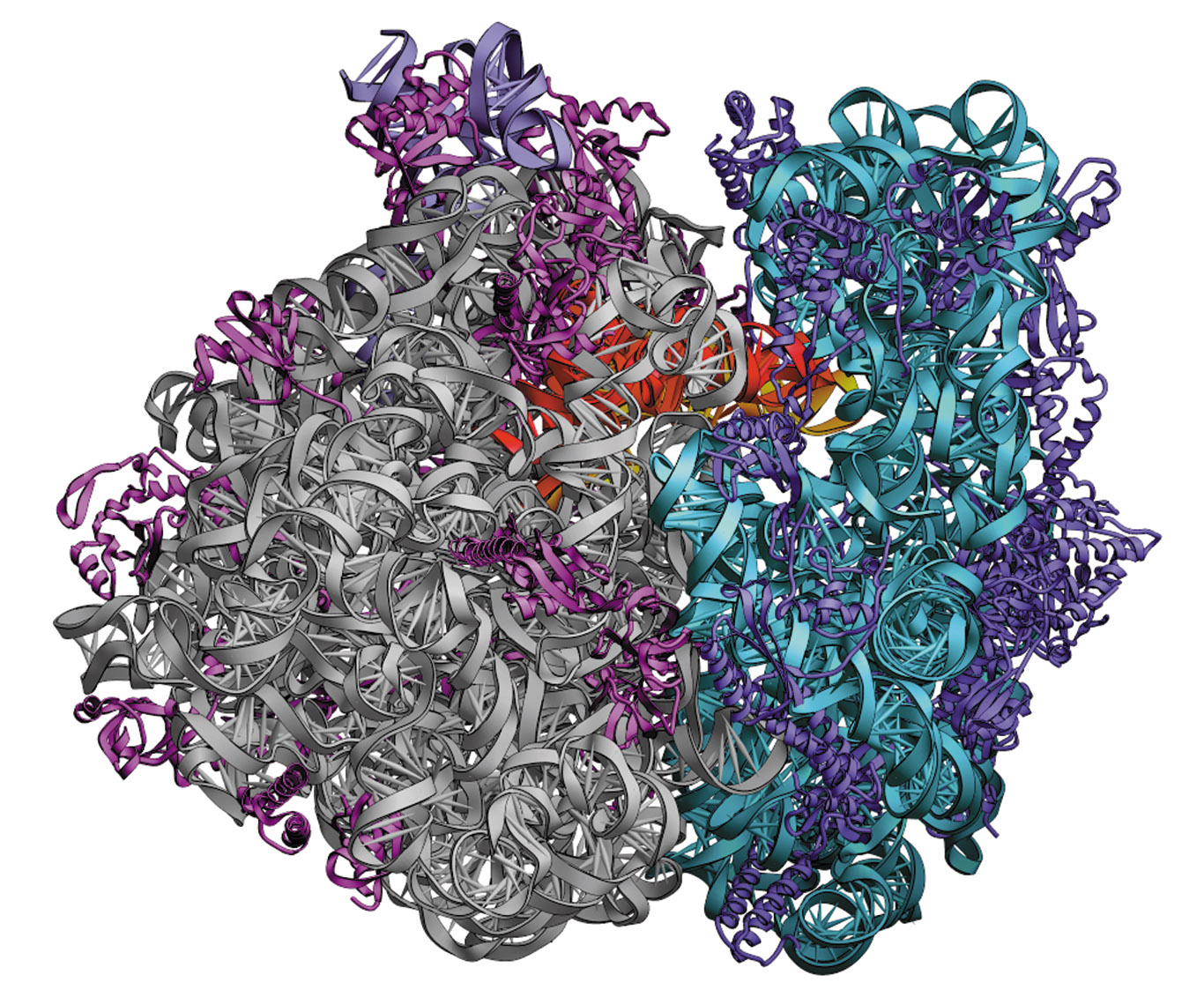 Estructura del ribosoma 70S (5,5 A ) de Thermus thermophilus (vista lateral izquierda). En la subunidad menor (30S) el rRNA se ha coloreado en celeste y las proteínas en azul oscuro. En la subunidad mayor (50S), el rRNA se ha coloreado en gris y las proteínas en magenta. Los tRNAs -superpuestos en esta vista- se han coloreado en rojo (sitio E), naranja (sitio P) y amarillo (sitio A). Imagen tomada de la Ref. 19
Estructura del ribosoma 70S (5,5 A ) de Thermus thermophilus (vista lateral izquierda). En la subunidad menor (30S) el rRNA se ha coloreado en celeste y las proteínas en azul oscuro. En la subunidad mayor (50S), el rRNA se ha coloreado en gris y las proteínas en magenta. Los tRNAs -superpuestos en esta vista- se han coloreado en rojo (sitio E), naranja (sitio P) y amarillo (sitio A). Imagen tomada de la Ref. 19
 Interior del ribosoma 70S de Thermus thermophilus, mostrando la localización del mRNA y de un tRNA (sitio P) en la región intermedia. También se muestra el canal de salida del polipéptido en recién sintetizado. (Noller lab)
Interior del ribosoma 70S de Thermus thermophilus, mostrando la localización del mRNA y de un tRNA (sitio P) en la región intermedia. También se muestra el canal de salida del polipéptido en recién sintetizado. (Noller lab)
Una vez establecidas la estructura de referencia del complejo funcional 70S, Harry Noller ha dedicado sus esfuerzos de investigación a estudiar la dinámica de la función ribosomal, un asunto que, como ya he comentado, me parece particularmente relevante. En la última década, además de numerosos estudios biofísicos, su grupo ha determinado nuevas estructuras cristalinas a partir de preparaciones de ribosomas «congelados» en diferentes estados funcionales. Estos estudios han contribuído -están contribuyendo- de manera decisiva, a nuestra comprensión de un mecanismo tan esencial para la vida como es la síntesis de proteínas. La cantidad de resultados recientes de calidad es tanta que daría, de sobra, para otro post pero no me resisto a cerrar éste sin mostrar una imagen que, 25 años después, refleja, a mi modo de ver, la principal virtud de un tipo tan especial como Harry Noller: su capacidad para apasionarse por un problema científico concreto, para formular la pregunta precisa y para obsesionarse con encontrar la respuesta adecuada aunque, como es el caso, tenga que dedicar su vida entera a ello. La imagen corresponde a la estructura de un ribosoma 70S en el que los tRNAs han sido atrapados en los estados intermedios A/P, P/E que describió, junto a Moazed y de manera mucho más rudimentaria (pero igualmente fascinante, para mi) en aquel Nature de 1989 (6) que tanto me impresionó durante los primeros años de mi formación investigadora.
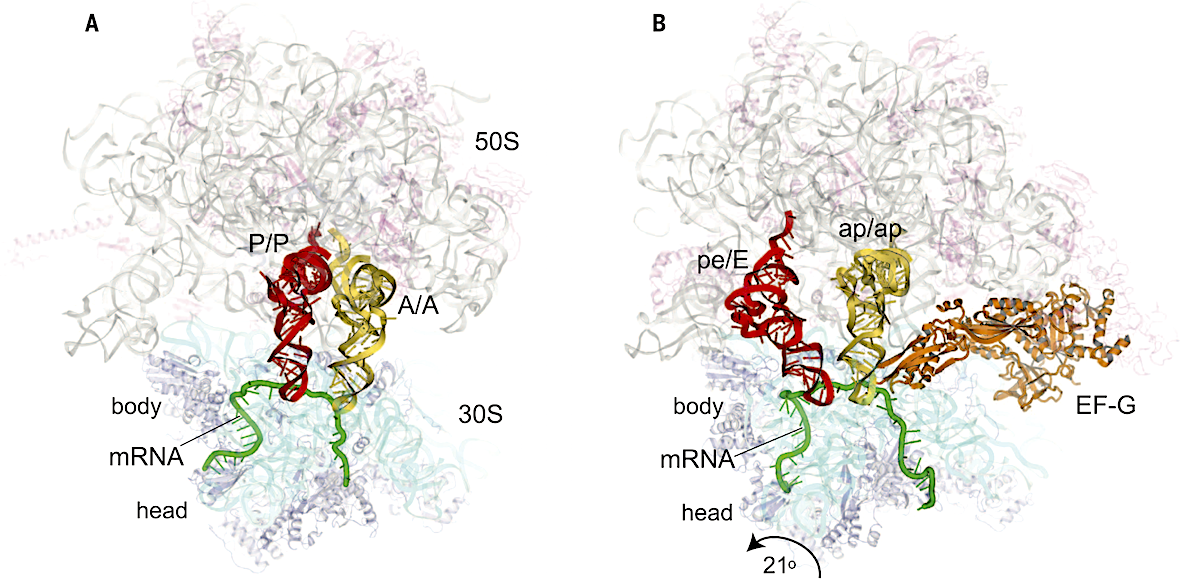 Movimiento de los rRNAs en la subunidad menor 30S. En A, los rRNAs se encuentran en los sitios clásicos A (amarillo) y P (rojo). En B se muestra el intermediario de translocación en el que los tRNAs se mueven, junto al mRNA (verde), a los sitios híbridos A/P y P/E. El movimiento se debe a que la subunidad 30S gira levemente en relación a la 50S, concretamente en la región donominada «cabeza». Imagen tomada de la Ref. 20.
Movimiento de los rRNAs en la subunidad menor 30S. En A, los rRNAs se encuentran en los sitios clásicos A (amarillo) y P (rojo). En B se muestra el intermediario de translocación en el que los tRNAs se mueven, junto al mRNA (verde), a los sitios híbridos A/P y P/E. El movimiento se debe a que la subunidad 30S gira levemente en relación a la 50S, concretamente en la región donominada «cabeza». Imagen tomada de la Ref. 20.
Para saber más sobre la vida y obra de Harry Noller merece la pena echar un vistazo al siguiente video que la UCSC ha preparado con ocasión de la concesión del premio Breakthrough 2017. Y por supuesto, su entretenidísimo artículo «By Ribosome Possessed» (1). La mayoría de citas de Noller que incluyo en este post están sacadas de ese artículo.
Sabiendo que escribiría este post durante las Navidades o en Año Nuevo, pensé que sería un buen regalo para los lectores (muy especialmente para los alumnos del MBCM) recibir del propio Harry Noller algunos consejos que, como científicos, les pudieran servir de ánimo y estímulo. Le escribí un correo al respecto y, demostrando una vez más que además de gran científico es un gran tipo, en menos de una hora tenía su respuesta en el buzón de entrada. Tras las palabras de Harry, encontraréis un video con música de jazz. Se trata de un clásico y una de sus composiciones favoritas. Lo incluyo como agradecimiento al gran Harry Noller y para introducir una música maravillosa a aquellos lectores que no la conozcan.
¡Feliz Año Nuevo!
Dear José,
(…)
For your students, I can only pass on to them what two of my own gurus said to me. Both of these guys received Nobel Prizes for their work (one of them twice), and were among the gods that we worshipped as postdocs in Cambridge.
1. Sydney Brenner. I was invited to a sherry (I guess I should say Jerez?) party at King’s College, Cambridge by a friend who was head of English Studies, when I was a young postdoc. It was terrifying. Everyone in the room, from undergrads to professors, were smarter than anyone I had ever met in the U.S. In the middle of this, I was approached by a guy who turns out to be one of the greatest scientific minds of the 20th century. He said: «Hello. My name is Sydney Brenner. Who are you? And what are you working on?» When I explained that I was working on the amino acid sequence of GAPDH, he replied «That’s stupid! If you’re a protein chemist, why don’t you work on something interesting, like the ribosome?» Needless to say, that conversation changed my life. What Sydney was saying – and he said this to many young scientists –was that you only have one life and one career, and you can spend it working on something boring or something exciting – it’s up to you. Strange to say, it had never occurred to me that it was up to me.
2. Fred Sanger. Several years after meeting Fred in Cambridge, I ran into him in the breakfast line at a meeting in Squaw Valley. He asked me what I was doing, and I explained to him a new method that I had worked out for identifying kethoxal-modified nucleotides in RNA. Being a methods guy himself, he listened with great interest as I explained how it worked, and asked lots of detailed questions. When I was done, he said «I’ll bet you tried a lot of things that didn’t work!». This remark came from the man whom I consider the greatest experimental scientist of the 20th century (inventor of protein sequencing, RNA sequencing and DNA sequencing). It is something that needs to be written on the walls of every lab in the world, to encourage students and postdocs and everyone not to give up, and that when you are working on something at the cutting edge of science, failed experiments are to be expected. It is easy to stay motivated when everything is working, but the real test is to go back to the bench and try again and again when things are not working.
All the best to you,
-Harry
PS: I just thought of an appropriate piece of music for you: “Concierto de Aranjuez” by Rodrigo, as played by Miles Davis and the Gil Evans orchestra on the album “Sketches of Spain”. It is one of my all-time favorite recordings. I find it profoundly beautiful.
https://www.youtube.com/watch?v=tSGUPsAeL34
Referencias.
1. Noller HF. 2013. By ribosome possessed. J Biol Chem 288:24872–24885.
2. Noller HF, Chaires JB. 1972. Functional modification of 16S ribosomal RNA by kethoxal. Proc Natl Acad Sci USA 69:3115–3118.
3. Noller HF. 1974. Topography of 16S RNA in 30S ribosomal subunits. Nucleotide sequences and location of sites of reaction with kethoxal. Biochemistry 13:4694–4703.
4. Noller HF, Woese CR. 1981. Secondary structure of 16S ribosomal RNA. Science 212:403–411.
5. Noller HF, Kop J, Wheaton V, Brosius J, Gutell RR, Kopylov AM, Dohme F, Herr W, Stahl DA, Gupta R, Woese CR. 1981. Secondary structure model for 23S ribosomal RNA. Nucl Acids Res 9:6167–6189.
6. Moazed D, Noller HF. 1989. Intermediate states in the movement of transfer RNA in the ribosome. Nature 342:142–148.
7. Stern S, Powers T, Changchien LM, Noller HF. 1989. RNA-protein interactions in 30S ribosomal subunits: folding and function of 16S rRNA. Science 244:783–790.
8. Moazed D, Robertson JM, Noller HF. 1988. Interaction of elongation factors EF-G and EF-Tu with a conserved loop in 23S RNA. Nature 334:362–364.
9. Woodcock J, Moazed D, Cannon M, Davies J, Noller HF. 1991. Interaction of antibiotics with A- and P-site-specific bases in 16S ribosomal RNA. EMBO J 10:3099–3103.
10. Noller HF, Hoffarth V, Zimniak L. 1992. Unusual resistance of peptidyl transferase to protein extraction procedures. Science 256:1416–1419.
11. Cech TR. 2000. The ribosome is a ribozyme. Science 289:878–879.
12. Frank J, Zhu J, Penczek P, Li Y, Srivastava S, Verschoor A, Radermacher M, Grassucci R, Lata RK, Agrawal RK. 1995. A model of protein synthesis based on cryo-electron microscopy of the E. coli ribosome. Nature 376:441–444.
13. Ban N, Freeborn B, Nissen P, Penczek P, Grassucci RA, Sweet R, Frank J, Moore PB, Steitz TA. 1998. A 9 A resolution X-ray crystallographic map of the large ribosomal subunit. Cell 93:1105–1115.
14. Ban N, Nissen P, Hansen J, Capel M, Moore PB, Steitz TA. 1999. Placement of protein and RNA structures into a 5 A-resolution map of the 50S ribosomal subunit. Nature 400:841–847.
15. Ban N, Nissen P, Hansen J, Moore PB, Steitz TA. 2000. The complete atomic structure of the large ribosomal subunit at 2.4 A resolution. Science 289:905–920.
16. Wimberly BT, Brodersen DE, Clemons WM, Morgan-Warren RJ, Carter AP, Vonrhein C, Hartsch T, Ramakrishnan V. 2000. Structure of the 30S ribosomal subunit. Nature 407:327–339.
17. Schluenzen F, Tocilj A, Zarivach R, Harms J, Gluehmann M, Janell D, Bashan A, Bartels H, Agmon I, Franceschi F, Yonath A. 2000. Structure of functionally activated small ribosomal subunit at 3.3 angstroms resolution. Cell 102:615–623.
18. Cate JH, Yusupov MM, Yusupova GZ, Earnest TN, Noller HF. 1999. X-ray crystal structures of 70S ribosome functional complexes. Science 285:2095–2104.
19. Yusupov MM, Yusupova GZ, Baucom A, Lieberman K, Earnest TN, Cate JH, Noller HF. 2001. Crystal structure of the ribosome at 5.5 A resolution. Science 292:883–896.
20. Zhou J, Lancaster L, Donohue JP, Noller HF. 2014. How the ribosome hands the A-site tRNA to the P site during EF-G-catalyzed translocation. Science 345:1188–1191.



